研究内容
Old ver.
なぜ肝臓・腸管に着目するのか?
肝臓は種々の病原微生物の標的臓器であることが知られています。例えば、宿主が細胞内寄生細菌に感染すると、その多く(約90%)は10分以内に肝臓に取り込まれます。そのため、肝臓がその後の菌の動態、並びに宿主生体防御機構の方向を決定すると言っても過言ではありません。また、腸管には無数の常在細菌が存在していることから、生体防御の第一線で働く重要な臓器であると考えられます。腸管には、末梢のリンパ組織に存在する細胞とは明らかに性状を異にする細胞の存在することが知られていますが、その生体内における役割については未だ不明な点も多く残されています。そのため、私たちは肝臓・腸管に存在する細胞に着目するのです。
これまでの研究内容と研究成果
NKT細胞
NKT細胞はこれまで均一な細胞集団であると考えられていました。しかし、私達の研究により、NKT細胞は性状の異なった幾つかの亜集団から構成されていることが明らかとなりました。NKT細胞の分類については様々な科学者により議論されてきましたが、私達は独自の分類法を確立しました。 2003年7月発行のTrends Immunol. (24: 364-369) に、これまで不明確であったNKT細胞の分類を分かり易く解説しましたので、興味のある方は読んでみて下さい。 またこの総説では、NKT細胞が肝臓に多い理由と肝臓における役割についても分かり易く解説してあります。 私達はこれまでに、細胞内寄生細菌感染により肝臓に存在するNKT細胞がフローサイトメトリーでは検出出来なくなることを報告してきま した。しかし、活性化によりNKT細胞上のNK1分子の発現がダウンレギュレートされるということが報告されていることから、NKT細胞の検出方法に問題があるのではないかという疑問が残されていました。そのため、私達はα-galactosylceramideをロードしたCD1dテトラマーを作成し、感染後の肝臓に存在するNKT細胞の動態を、このテトラマーを用いて解析しました。その結果、多くのNKT細胞は感染早期に産生される Interleukin(IL)-12によりアポトーシスを起こすが、かなりの数のNKT細胞は依然肝臓に存在すること、またその細胞はInterferon-γ産生能を有しているが、IL-4産生能は消失していることが明らかとなりました。このことは、感染後も肝臓に存在するNKT細胞が感染防御に重要な役割を演じていることを示唆しています。
腸管上皮間リンパ球
腸管には、分化や機能の面において通常のリンパ組織に存在する細胞とは明らかに性状を異にする細胞群が多数存在します。私達は、これまでに報告さ れている細胞とは明らかに性状を異にする細胞集団が腸管内に存在することを見い出しました。通常、腸管にはα/β型T細胞に加えて、多数のγ/δ 型T細胞が存在しますが、その殆どはCD8分子としてα鎖は発現するが、β鎖は発現しないCD8α/α細胞です。しかし私達は、先天的に胸腺を欠損する ヌードマウスの腸管に、CD8分子としてα鎖並びにβ鎖の両者を発現する(CD8α/β)γ/δ型T細胞が存在すること、またこの細胞が、極めて強い生物 活性を有することを見い出しました。このことは、2004年1月発行のInt. Immunol.(16:1-7)に掲載されましたので、興味のある方は読んでみてください。
白血球機能関連抗原
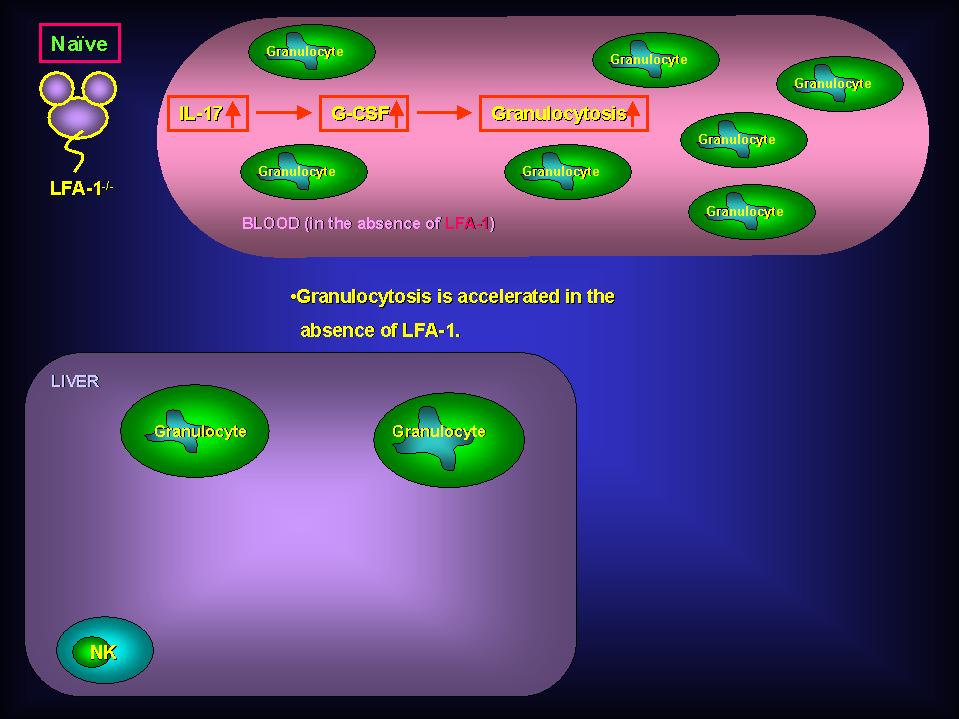
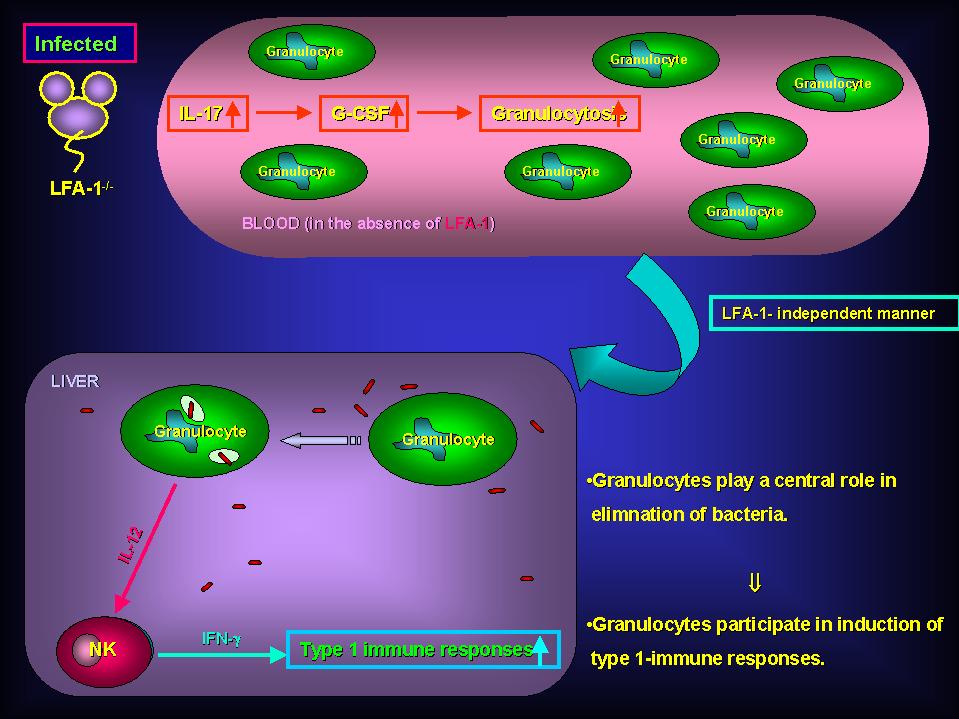
宿主が細胞内寄生細菌の感染を受けると、まず最初に好中球が肝臓に浸潤し、肝臓に取り込まれた多くの細菌が貪食・殺菌されます。そのため、好中球は第一線で働く極めて重要な細胞であると考えられます。私達は、この初期防御に重要である好中球並びに炎症細胞の浸潤に重要と考えられている白血球機能関連抗原?1(Leukocyte Function Associated Antigen-1(LFA-1))分子に着目し、好中球とLFA-1分子の細胞内寄生細菌感染における役割を解析しました。その結果、これまで考えられていた概念とは相反し、LFA-1分子欠損状態のほうがより効率良く好中球が肝臓に浸潤することが明らかとなりました。また、その機構に Granulocyte-Colony Stimulating Factor並びにInterleukin (IL)-17が深く関与していることも明らかとなりました。このことは、2003年5月発行のJ. Immunol.(170:5228-5234)に掲載されましたので興味のある方は読んでみてください。
これまで、LFA-1はタイプ1の免疫応答誘導に深く関与すると考えられていました。しかし、マウスリステリア感染症をモデルに検討した結果、 LFA-1分子はタイプ1の免疫応答誘導を抑制するように働くことが明らかとなりました。また、これまで、マクロファージがInterleukin-12 の主な産生細胞であると信じられていましたが、少なくとも肝臓では好中球が主なIL-12産生細胞であることも明らかとなりました。このことは2003年 10月発行のJ. Immunol.(171:3970-3976)に掲載されましたので、興味のある方は読んでみてください。
エンドトキシンショック
エンドトキシンショックは、グラム陰性菌並びにその細胞壁構成成分であるLPSにより誘導される炎症性サイトカインの過剰産生によって引き起こされる致死性のショックです。炎症性サイトカインの中でも、特に腫瘍壊死因子(TNF)-αがエンドトキシンショックの誘発に中心的役割を演じていますが、インターフェロン(IFN)-γも一翼を担っていることが知られています。これまでの研究により、NK1分子はNK細胞だけでなくNKT細胞上にも発現されていること、並びに両細胞共、IFN-γを産生することが明らかになっていることから、両細胞がエンドトキシンショックの病態に関与している可能性があります。しかし、どちらの細胞がエンドトキシンショックに、より重要な役割を演じているのかについては明らかではありませんでした。そのため、私達は、NK細胞とNKT細胞のどちらがエンドトキシンショックの誘発に重要かを明らかにするべく実験を行い、NKT細胞よりも寧ろNK細胞のほうが、エンドトキシンショックの誘発に重要であることを明らかにしました。このことは、2002年発行のJ. Immunol.(169:1426-1432)に報告していますし、総説として2003年7月発行のArch. Immunol. Therap. Exp.(51:231-236)に書きましたので、興味のある方は読んでみてください。
マウスはヒトと違い、エンドトキシンショックに対して抵抗性を示しますが、High doseのリポ多糖(LPS)を投与すると、エンドトキシンショックを誘発するようになります。また、Low doseのLPSとD-galactosamine(肝臓の代謝抑制剤)を同時に投与するとによって、極めて酷い肝障害を伴ったショック症状を誘発するこ とが知られています(Low-dose LPS-shock model)。High-dose LPS-shock modelと同様、TNF-αがこの病態に中心的役割を演じていますが、感受性を決定する因子がTNF-αだけではないのではないかという仮説をたて、種 々の遺伝子欠損マウスを用いて肝障害誘発機構を検討しました。その結果、血中のTNF-αが高い状態でも、Interleukin (IL)-10がある閾値を越えて生体内に存在している場合には、肝障害の起こらないことが明らかとなりました。IL-10は、TNF-αよりも遅れて産 生されることから、IL-10の治療への応用が期待されます。このことは、2003年7月発行のJ. Immunol.(171: 584-593)に掲載されましたので、興味のある方は読んでみてください。
今後の目標
肝臓並びに腸管には、これまでに知られていない細胞群の多数存在することが私たちのこれまでの研究により明らかになってきました。そのため、今後はこれら細胞群の生体内における役割を、各種遺伝子欠損マウスを用いて解析したいと思っています。